 杨冰
杨冰 当“一滴血测多癌”的概念首次进入公众视野时,它曾被冠以“癌症早筛革命”的称号。资本市场的热捧、媒体的渲染以及公众对癌症筛查的迫切需求,让这一技术迅速成为医疗健康领域的焦点。然而,近期曝光的科研造假、数据夸大等争议事件,却让整个行业陷入前所未有的信任危机。这场风波不仅动摇了投资者对百亿级赛道的信心,也让普通民众对癌症早筛技术的可靠性产生质疑。技术神话的破灭背后,暴露的是行业浮躁、监管滞后与科学伦理的失衡。
一、技术光环下的“一滴血”神话
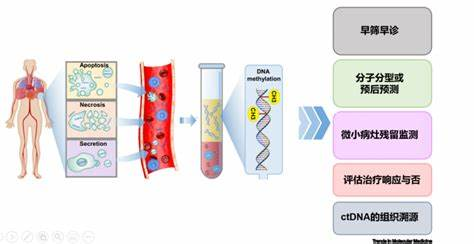
1. 液体活检:癌症早筛的“理想答案”
液体活检技术的核心逻辑在于通过血液、尿液等体液中的循环肿瘤DNA(ctDNA)、外泌体或特定蛋白标志物,检测早期癌症信号。与传统影像学检查或侵入式活检相比,其“无创、便捷、可重复”的特点完美契合了早筛的需求。尤其在多癌种联合检测场景下,理论上只需一次抽血即可筛查多种癌症,极大降低了筛查门槛。
2. 资本狂欢与市场想象
全球癌症早筛市场规模预计在2030年突破千亿美元,而“多癌种早筛”被视为最具潜力的细分领域之一。头部企业如Grail、Thrive等公司凭借临床试验的阶段性成果,迅速获得数十亿美元融资。在国内,这一赛道同样火热,2021年至2023年间,国内相关企业融资总额超过200亿元人民币。市场对技术的期待已远超科学进展本身,演变为一场“抢占未来”的资本竞赛。
3. 公众认知的“技术乌托邦”
在社交媒体和商业宣传的推动下,“一滴血测癌”被简化为“癌症早筛=抽血即检”,公众误以为技术已完全成熟。这种认知偏差导致用户对检测结果的过度依赖,甚至出现“替代现有筛查手段”的激进观点,为后续争议埋下伏笔。
二、造假风波:科学理想主义与商业现实的碰撞

1. 争议事件的引爆点
2023年,某知名早筛企业被曝临床试验数据存在人为篡改痕迹。调查显示,其宣称的“灵敏度95%”“特异性99%”等关键指标,实际源于对数据的选择性使用和统计学操纵。更严重的是,部分样本来源的真实性存疑,存在重复使用或标注错误等问题。消息一经披露,企业股价单日暴跌60%,并引发连锁反应。
2. 技术瓶颈的“系统性遮掩”
造假行为背后折射出行业普遍困境:ctDNA在早期癌症中的含量极低(可能低至0.01%),且个体差异显著。现有技术难以在高噪声背景下稳定识别信号,导致灵敏度和特异性难以兼顾。部分企业为迎合资本需求,选择掩盖技术缺陷,甚至虚构临床价值。
3. 监管与伦理的双重失守
多数国家尚未建立针对多癌种早筛的专门监管框架。以美国为例,FDA虽批准了部分单癌种早筛产品,但对多癌种检测仍持审慎态度。在国内,LDT(实验室自建检测)模式的监管灰色地带,使得部分企业得以绕过严格的审批流程,直接向市场推出未经充分验证的产品。
三、行业震荡:从资本寒冬到信任重建

1. 资本市场的“退潮效应”
造假事件后,一级市场对早筛赛道的投资热度骤降。2024年优先季度,全球癌症早筛领域融资额同比减少72%,多家企业IPO进程被迫搁置。投资者从“追捧故事”转向“拷问数据”,要求企业提供更长周期的临床随访结果和成本效益分析。
2. 公众信任的“修复难题”
一项针对万名用户的调查显示,65%的受访者表示“暂不考虑购买多癌早筛产品”,48%认为“现有技术不可靠”。信任崩塌不仅影响商业化进程,更可能拖累整个液体活检技术的应用前景——包括已相对成熟的单癌种检测市场。
3. 监管层的“紧急刹车”
各国药监部门加快完善技术评价体系。例如,国内NMPA于2024年发布《多癌种早筛产品临床试验指导原则》,要求企业提供至少5年随访数据,并明确区分“筛查”与“辅助诊断”的适应症范围。欧盟则计划将多癌早筛纳入IVDR(体外诊断医疗器械法规)的高风险类别管理。
四、破局之路:技术回归与生态重构
1. 从“替代神话”到“补充定位”
学术界开始反思早筛技术的边界。美国国立癌症研究所(NCI)公开呼吁,液体活检应定位于“高风险人群的初筛工具”,而非全民普筛。与影像学、内镜等传统手段的联合应用模式,成为新的研究重点。
2. 技术迭代的“务实路径”
· 信号富集技术:通过纳米材料、微流控芯片提升ctDNA捕获效率;
· 多组学交叉验证:整合甲基化、片段组学、蛋白质标志物等多维度数据;
· AI驱动的噪声过滤:利用深度学习区分肿瘤信号与生理噪声。
3. 商业模式的“价值再定义”
企业开始转向B2B2C模式,与保险公司、体检机构合作,将早筛嵌入分级诊疗体系。例如,与商业保险结合推出“早筛+随访+治疗”的一体化服务,通过降低保费反哺技术成本。
五、未来展望:在科学与商业的平衡木上
癌症早筛的需求不会因一场风波消失,但行业必须接受一个现实:技术的成熟需要时间,商业的成功必须建立在科学严谨性之上。短期来看,市场将经历残酷洗牌,缺乏核心数据支撑的企业将被淘汰;长期而言,坚持长期主义、构建“临床-产业-监管”协同生态的玩家有望胜出。对于公众而言,这场危机或许是一次重要的科普教育——医学进步没有“捷径”,但每一次挫折都在推动人类离真相更近一步。
结语:信任的代价与技术的救赎
造假风波揭开了癌症早筛行业的“皇帝新衣”,却也倒逼了一场必要的行业净化。当资本泡沫退去,科学共同体的自省、监管框架的完善以及公众认知的理性回归,将成为技术突破的真正基石。癌症早筛的故事远未终结,但它必须在一个更清醒、更坚韧的叙事中重新开始。





















