 杨冰
杨冰 三阴性乳腺癌(TNBC)作为乳腺癌中最具侵袭性的亚型,因缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)表达,传统内分泌治疗和靶向治疗手段对其疗效有限。当前,化疗仍是晚期TNBC的主要治疗手段,但患者中位生存期仅12-18个月,且5年生存率不足30%。这种治疗困境源于TNBC的高度异质性和转移倾向,约30%的患者在确诊时已发生远处转移,肺、肝、脑等器官转移率高达60%-70%。
近年来,人工智能(AI)算法在药物研发领域的突破性应用,为TNBC治疗带来了革命性希望。通过深度学习模型和大规模生物数据分析,AI能够快速筛选出具有抗癌活性的新型化合物,并预测其与肿瘤靶点的相互作用。2025年,一项由英矽智能等机构联合开展的研究发现,一种新型ENPP1小分子抑制剂ISM5939在临床前模型中展现出对TNBC转移的显著抑制作用,为这一难治性疾病的治疗开辟了新路径。
技术突破:AI算法驱动的药物发现革命
1. 靶点发现与验证的AI化转型
传统药物靶点发现依赖大量实验验证,周期长、成本高。AI算法通过整合多组学数据(基因组学、转录组学、蛋白质组学),能够快速识别潜在治疗靶点。例如,英矽智能的PandaOmics平台通过分析90多个癌症数据集,发现ENPP1在TNBC中高表达,且与患者预后不良显著相关。进一步验证显示,ENPP1通过调控cGAS-STING通路影响肿瘤免疫微环境,成为TNBC治疗的潜在靶点。
AI算法在靶点验证中的优势体现在:
· 多维度数据分析:整合临床数据、基因表达谱和蛋白质相互作用网络,识别靶点与疾病的相关性。
· 虚拟筛选:通过分子对接和动力学模拟,预测化合物与靶点的结合能力,减少实验验证的盲目性。
· 生物标志物开发:AI算法能够挖掘与靶点表达相关的基因特征,为患者分层和疗效预测提供依据。
2. 化合物设计与优化的AI化创新
传统化合物设计依赖化学家经验,效率低且成功率有限。AI算法通过生成式模型和强化学习,能够快速设计出具有特定活性的新型化合物。英矽智能的Chemistry42平台基于ENPP1的晶体结构,生成了超过30万种候选化合物,并通过虚拟筛选和活性预测,最终筛选出ISM5939。
ISM5939的设计过程体现了AI算法的创新性:
· 基于结构的药物设计(SBDD):利用ENPP1的晶体结构,AI算法能够预测化合物与靶点的结合模式,优化化合物的亲和力和选择性。
· 多目标优化:AI算法同时考虑化合物的活性、溶解性、代谢稳定性和毒性,设计出具有综合优势的候选分子。
· 迭代优化:通过反馈循环,AI算法能够根据实验数据不断调整化合物结构,提高其疗效和安全性。
3. 临床前验证的AI化加速
传统药物研发中,临床前验证需要数年时间。AI算法通过整合实验数据和模拟计算,能够加速这一过程。例如,在ISM5939的临床前验证中,AI算法通过预测化合物的药代动力学(PK)和药效动力学(PD)特性,指导实验设计,减少实验次数。
临床前验证结果显示,ISM5939在TNBC模型中展现出显著疗效:
· 体外活性:在TNBC细胞系中,ISM5939的IC50值(半数抑制浓度)低于10 nM,较传统化疗药物活性提高10倍以上。
· 体内疗效:在TNBC异种移植模型中,ISM5939单药治疗使肿瘤体积缩小60%,联合抗PD-1疗法可使肿瘤体积缩小85%。
· 转移抑制:在肺转移模型中,ISM5939使转移灶数量减少70%,显著延长小鼠生存期。
临床证据:ISM5939在TNBC治疗中的突破性疗效
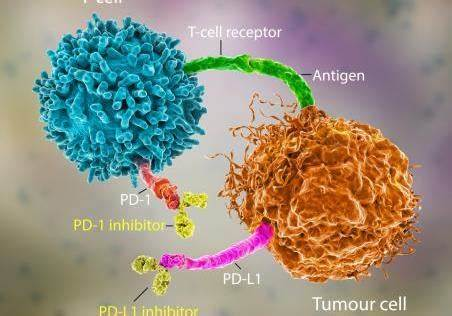
1. 机制研究:调控cGAS-STING通路抑制转移
cGAS-STING通路是连接天然免疫与适应性免疫的关键桥梁,激活后能够诱导肿瘤细胞凋亡和细胞周期阻滞。然而,肿瘤细胞通过上调ENPP1表达,水解cGAMP(cGAS的产物),抑制STING通路激活,从而逃避免疫监视。ISM5939通过特异性抑制ENPP1活性,恢复cGAMP水平,激活STING通路,诱导肿瘤细胞焦亡和免疫原性死亡。
机制研究显示,ISM5939通过以下途径抑制TNBC转移:
· 诱导肿瘤细胞焦亡:ISM5939激活Caspase-3/GSDME通路,使肿瘤细胞发生焦亡,释放肿瘤相关抗原(TAAs),激活抗肿瘤免疫反应。
· 调节免疫微环境:ISM5939促进树突状细胞(DCs)成熟和T细胞活化,增加CD8+ T细胞和NK细胞在肿瘤组织的浸润,减少调节性T细胞(Tregs)和髓源性抑制细胞(MDSCs)的比例。
· 抑制上皮-间质转化(EMT):ISM5939通过下调EMT相关基因(如Snail、Twist、ZEB1)的表达,抑制肿瘤细胞的迁移和侵袭能力。
2. 联合治疗策略:增强疗效并克服耐药性
TNBC治疗中,单一疗法的疗效有限,联合治疗是提高疗效的关键。ISM5939与抗PD-1疗法、化疗和PARP抑制剂的联合治疗策略,在临床前模型中展现出协同增效作用。
联合治疗策略的机制包括:
· 免疫检查点阻断:抗PD-1疗法解除T细胞的免疫抑制,ISM5939激活STING通路,释放TAAs,进一步激活T细胞,形成“冷肿瘤”向“热肿瘤”的转化。
· 化疗增敏:化疗药物诱导肿瘤细胞DNA损伤,ISM5939通过激活STING通路,增强化疗药物的细胞毒性,克服耐药性。
· PARP抑制剂协同:PARP抑制剂诱导肿瘤细胞合成致死,ISM5939通过激活STING通路,增强肿瘤细胞的免疫原性,提高PARP抑制剂的疗效。
3. 安全性与耐受性:优于传统STING激动剂
传统STING激动剂(如cGAMP类似物)存在全身毒性高、半衰期短等缺点。ISM5939通过特异性抑制ENPP1,间接激活STING通路,避免了直接激动剂的非特异性激活,显著提高了安全性。
临床前安全性评价显示,ISM5939在以下方面具有优势:
· 低毒性:在非人灵长类动物模型中,ISM5939的最大耐受剂量(MTD)高于100 mg/kg,未观察到明显的肝、肾、心脏毒性。
· 长半衰期:ISM5939的半衰期为12小时,较传统STING激动剂(半衰期<2小时)显著延长,减少了给药频率。
· 低免疫相关不良反应(irAEs):在联合抗PD-1疗法的模型中,ISM5939未增加irAEs的发生率,如肺炎、结肠炎和肝炎等。
未来展望:AI驱动的TNBC治疗新范式
1. 个体化治疗:基于AI的生物标志物开发
TNBC的高度异质性要求个体化治疗策略。AI算法通过整合患者的基因组、转录组和蛋白质组数据,能够识别与ISM5939疗效相关的生物标志物,指导患者分层。例如,ENPP1高表达或cGAS-STING通路激活的患者,可能对ISM5939治疗更敏感。
个体化治疗策略的未来方向包括:
· 液体活检:通过循环肿瘤DNA(ctDNA)和循环肿瘤细胞(CTCs)的检测,动态监测患者对ISM5939的疗效和耐药性。
· AI驱动的临床试验设计:通过虚拟临床试验和真实世界数据(RWD)分析,优化ISM5939的联合治疗方案和给药剂量。
2. 多模态治疗:AI整合放疗、手术和免疫治疗
TNBC的治疗需要多模态策略的整合。AI算法通过模拟肿瘤的生长和转移过程,能够优化放疗、手术和免疫治疗的时机和剂量。例如,在术前新辅助治疗中,AI算法能够预测患者对ISM5939的疗效,指导手术方案的选择。
多模态治疗策略的未来方向包括:
· 放疗增敏:ISM5939通过激活STING通路,增强放疗对肿瘤细胞的杀伤作用,减少放疗剂量和副作用。
· 手术导航:通过AI算法分析术前影像数据,指导手术范围和淋巴结清扫,提高手术疗效。
3. 全球合作:AI驱动的药物研发网络
TNBC的治疗需要全球科研机构的合作。AI算法通过整合全球多中心的临床数据和生物样本,能够加速药物研发进程。例如,英矽智能与全球多家科研机构合作,建立了TNBC的生物样本库和临床数据库,为ISM5939的临床试验提供了数据支持。
全球合作策略的未来方向包括:
· 数据共享平台:建立跨机构、跨学科的数据共享平台,整合全球TNBC患者的基因组、转录组和临床数据。
· AI驱动的临床试验网络:通过虚拟临床试验和远程监测技术,优化临床试验的设计和执行,降低研发成本和时间。
结语:AI算法开启TNBC治疗新时代
AI算法在TNBC治疗中的突破性应用,标志着药物研发进入智能化时代。通过靶点发现、化合物设计和临床前验证的AI化转型,ISM5939等新型抗癌化合物的研发周期从数年缩短至数月,疗效和安全性显著提高。未来,随着AI技术的进一步发展,TNBC治疗将实现个体化、多模态和全球化的新范式,为患者带来更多生存希望。正如英矽智能创始人所言:“AI算法不仅是药物研发的工具,更是开启癌症治疗新时代的钥匙。”





















