 杨冰
杨冰 近年来,儿童恶性肿瘤的治疗领域不断迎来突破性进展。神经母细胞瘤作为儿童最常见的颅外实体肿瘤之一,因其恶性程度高、易复发和转移的特点,长期被视为临床治疗的“硬骨头”。而在我国西北地区,由于医疗资源分布不均,高危神经母细胞瘤患儿的生存率一度低于全国平均水平。然而,近期西北某大型儿童医院成功完成了一例高危神经母细胞瘤自体造血干细胞移植手术,并通过CAR-T细胞技术构建了预防复发的“双保险”,标志着区域儿童肿瘤治疗水平迈入新台阶。这一案例不仅为患儿带来生的希望,也为我国基层医疗的肿瘤综合治疗提供了重要参考。
一、神经母细胞瘤:儿童肿瘤中的“隐形杀手”
神经母细胞瘤起源于交感神经系统的胚胎细胞,多发于5岁以下儿童,占儿童恶性肿瘤的8%-10%。其临床表现隐匿,早期症状常与普通儿科疾病混淆,如腹痛、发热或肢体疼痛,导致约半数患儿确诊时已进入高危阶段。根据国际神经母细胞瘤分期系统(INSS),高危患者通常存在骨髓转移、骨骼侵犯或MYCN基因扩增等特征,即使接受手术切除、高强度化疗和放疗,5年生存率仍不足50%。
传统治疗方案的局限性体现在两方面:一是高强度化疗虽能暂时缩小肿瘤,但对患儿免疫系统破坏极大,可能引发感染、器官衰竭等并发症;二是肿瘤细胞易产生化疗耐药性,微小残留病灶(MRD)成为复发的“定时炸弹”。因此,自体造血干细胞移植(ASCT)逐渐成为高危患儿的标准治疗手段——通过超大剂量化疗清除体内癌细胞后,回输预先采集的患者自体干细胞,重建造血功能。然而,自体移植后复发率仍高达30%-40%,如何进一步巩固疗效成为全球医学界的攻关方向。
二、破局之战:西北首例自体移植的里程碑意义

此次接受治疗的患儿小宇(化名)年仅3岁,确诊时肿瘤已侵犯腹膜后淋巴结并伴随骨髓转移,MYCN基因呈阳性扩增,属于典型高危组。在经历4轮诱导化疗后,肿瘤体积缩小60%,但骨髓中仍可检测到微小残留病灶。医疗团队综合评估后,决定启动自体移植联合CAR-T技术的序贯治疗方案。
1. 自体移植:精准把控“摧毁与重建”的平衡
自体移植的核心在于“先破后立”。首先,通过“马法兰+卡铂+依托泊苷”的超大剂量化疗方案,最大限度杀灭残留癌细胞。这一过程犹如“刮骨疗毒”,需在21天内完成化疗药物输注,期间患儿白细胞一度降至近乎为零,免疫力几乎完全丧失。医疗团队通过层流病房隔离、抗生素预防感染和营养支持,成功规避了脓毒症等致命风险。
随后,回输预先采集的造血干细胞成为“生命重启”的关键。这些干细胞通过白细胞单采术从小宇体内提取,并在零下196℃的液氮中保存。回输后第12天,中性粒细胞成功植入;第28天,血小板恢复至安全水平,标志着移植成功。移植后评估显示,骨髓MRD转为阴性,影像学检查未见明显肿瘤活性。
2. CAR-T技术:为长期生存加上“生物锁”
尽管自体移植取得阶段性成功,但小宇体内仍可能存在逃逸的肿瘤细胞。为此,医疗团队提前制定预案:若移植后3个月内出现复发迹象,立即启动CAR-T细胞治疗。CAR-T(嵌合抗原受体T细胞)技术通过基因工程改造患者自身的T细胞,使其能够特异性识别并攻击肿瘤细胞。针对神经母细胞瘤,靶点选择尤为关键——GD2抗原在神经母细胞瘤细胞表面高表达,而在正常组织中分布极少,使其成为理想靶标。
目前,小宇的淋巴细胞已提前采集并冻存,一旦需要,可快速制备靶向GD2的CAR-T细胞。这种“双保险”策略将自体移植的短期清除效应与CAR-T的长期免疫监视相结合,显著降低复发风险。此外,团队还计划在移植后6个月为小宇接种肿瘤疫苗,进一步激活免疫记忆。
三、技术解析:CAR-T如何成为复发防控的“守门员”
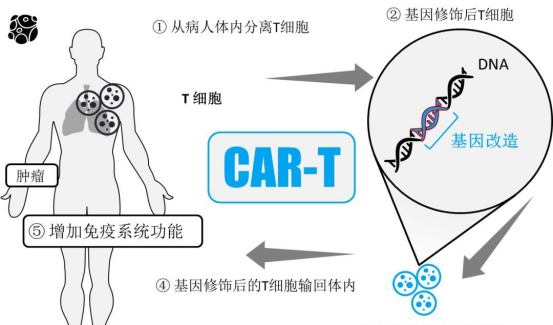
CAR-T技术的核心在于赋予T细胞“精准制导”能力。传统T细胞依靠表面的TCR受体识别抗原,但肿瘤细胞常通过下调MHC分子表达逃避免疫监视。CAR-T细胞通过人工设计的嵌合抗原受体,绕过MHC限制,直接与肿瘤表面抗原结合,激活T细胞的杀伤机制。以GD2为靶点的CAR-T已在多项临床试验中展现潜力:2022年《新英格兰医学杂志》报道的Ⅰ期试验显示,复发/难治性神经母细胞瘤患儿的客观缓解率达63%,且不良反应可控。
然而,CAR-T在实体瘤中的应用仍面临挑战:一是肿瘤微环境的免疫抑制屏障,如调节性T细胞(Treg)和PD-L1高表达;二是靶抗原的异质性可能导致脱靶效应。为此,新一代CAR-T技术开始整合“双靶点设计”(如GD2/B7-H3)、联合免疫检查点抑制剂或溶瘤病毒,以提升穿透力和持久性。小宇病例中采用的GD2 CAR-T属于成熟靶点,其安全性和有效性已得到初步验证,尤其适合作为移植后的巩固治疗。
四、区域医疗突围:从“跟跑”到“并跑”的启示
西北地区首例儿童高危神经母细胞瘤自体移植成功的背后,是区域医疗资源整合与技术创新的双重突破。以往,此类患儿需转诊至北上广深的一线医院,但长途奔波可能延误治疗时机。此次手术的医院通过“筑巢引凤”,组建了包括血液肿瘤科、移植中心、细胞治疗实验室的多学科团队,并引入自动化血细胞分离仪、程序降温仪等关键设备,构建了完整的移植技术链条。
此外,医院与国内知名CAR-T研发机构建立合作,打通了细胞采集、运输、制备和回输的全流程。这一模式证明,通过技术下沉和远程协作,区域医疗中心完全有能力开展高难度儿童肿瘤综合治疗,缓解患者跨省就医的压力。
五、未来展望:个体化治疗与早筛体系的构建
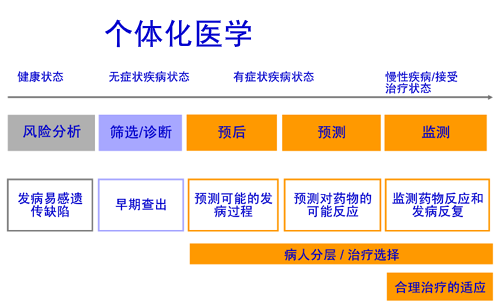
小宇的成功案例为儿童神经母细胞瘤治疗提供了新思路,但全面改善预后仍需多管齐下:
分子分型指导个体化治疗:通过二代测序(NGS)检测ALK、PHOX2B等驱动基因突变,筛选靶向药物(如ALK抑制剂劳拉替尼)与免疫治疗的适用人群。
液态活检动态监测MRD:利用循环肿瘤DNA(ctDNA)和循环肿瘤细胞(CTC)检测,在影像学发现病灶前预警复发风险。
普及新生儿筛查:研究显示,部分神经母细胞瘤在胎儿期即可通过超声发现,早期干预可显著提升低危患儿的自愈概率。
结语
从自体移植到CAR-T防复发,西北地区这一里程碑式的治疗案例,不仅代表了个体生命的重生,更折射出我国儿童肿瘤诊疗体系的进步。随着精准医学与免疫治疗的深度融合,未来有望通过“移植+细胞治疗+靶向药物”的组合拳,将高危神经母细胞瘤变为可长期控制的慢性病。而区域医疗中心的崛起,则为实现“大病不出省”的医改目标注入强心剂。在这场与死神的赛跑中,技术与协作的力量,正在为更多家庭点亮希望之光。





















