 杨冰
杨冰 引言:传统中药的现代困境与破局之需
中药材作为中华文明的瑰宝,承载着数千年临床实践的智慧结晶。然而,随着全球对天然药物需求的激增,传统中药材产业正面临双重挑战:一方面,人参、三七等名贵药材因过度采挖导致野生资源濒危,生物多样性保护迫在眉睫;另一方面,传统种植模式受气候、病虫害等不可控因素影响,药材质量波动大,难以满足工业化生产对原料稳定性的要求。在此背景下,合成生物学技术以其“设计生命、智造健康”的颠覆性优势,为中药材产业开辟了一条兼顾生态保护与可持续发展的第三条道路——通过实验室精准培育稀有人参皂苷等活性成分,实现从“靠天吃饭”到“智能智造”的跨越。
一、稀有人参皂苷:传统药材的“黄金密码”与现代困境

(一)稀有人参皂苷的独特价值
人参皂苷是人参等五加科植物的核心活性成分,其中稀有人参皂苷(如Rh1、Rh2、Rg3、CK等)因糖基较少、生物利用度高,在抗肿瘤、抗炎、神经修复等领域展现出显著优势。例如,Rh1可通过清除自由基保护心血管,Rh2能诱导肿瘤细胞凋亡,Rg3则被证实可抑制肿瘤血管生成。然而,这些“植物黄金”在天然人参中的含量极低(通常不足0.01%),且需通过复杂的脱糖基化反应转化生成,导致其市场价格远超黄金(每克超2万元),成为制约临床应用的瓶颈。
(二)传统生产模式的局限性
资源依赖性高:野生人参生长周期长达15-20年,且对生态环境要求严苛,过度采挖已导致长白山等产区资源濒临枯竭。
提取工艺复杂:传统方法需先种植人参,再通过酸水解或酶解法转化稀有人参皂苷,流程冗长且产率低下(如Rh2的转化率不足5%)。
环境代价沉重:人参种植需大量化肥农药,易引发土壤退化;提取过程产生的有机溶剂废液若处理不当,将严重污染水源。
二、合成生物学:重构中药制造的“细胞工厂”
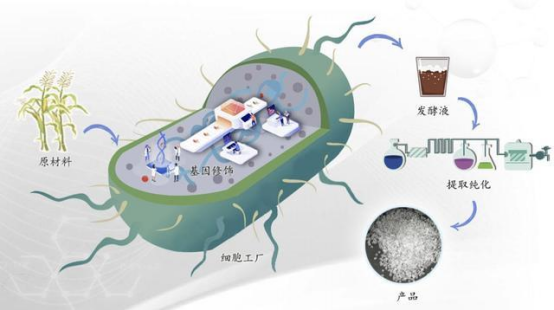
(一)技术原理:从基因编辑到代谢通路的精准调控
合成生物学通过基因编辑、代谢工程等手段,将微生物或植物细胞改造为“微型工厂”,实现目标成分的高效合成。以稀有人参皂苷为例,其生物合成路径可分为三个阶段:
前体供应:通过强化酵母的甲羟戊酸(MVA)途径,提升异戊二烯焦磷酸(IPP)等三萜类化合物前体的产量。
骨架构建:利用法尼基焦磷酸合酶(FPS)、鲨烯合酶(SS)等酶,将IPP转化为达玛烯二醇,形成皂苷基本骨架。
修饰与转化:通过细胞色素P450酶(CYP450)进行羟基化,再由糖基转移酶(UGT)添加糖基,最终生成不同种类的稀有人参皂苷。
(二)关键突破:从实验室到产业化的技术跃迁
底盘细胞优化:
研究者选择酿酒酵母而非大肠杆菌作为宿主,因其具备真核生物特有的酶系统(如CYP450),可完成复杂的糖基化和氧化修饰;同时,酵母的液泡能存储毒性中间产物,避免代谢抑制。例如,天津大学团队通过基因编辑构建的酵母细胞工厂,已实现Rh2的滴度达5.74克/升,较传统方法提升数百倍。酶工程改造:
针对关键酶活性低的问题,科学家采用半理性设计、定向进化等技术提升其催化效率。例如,华南理工大学团队通过AlphaFold2预测糖基转移酶结构,结合FBA代谢建模,成功将Rh1的合成效率提升至每升溶液含800毫克,且产物纯度达98%以上。前体与辅因子调控:
通过过表达NADPH合成相关基因(如PGM2、UGP1),增强糖基转移反应所需的UDP-葡萄糖供应;同时,优化酵母的MVA途径关键限速酶(如HMGR、FPS),使前体IPP的产量提升3倍以上。
三、生态与产业的双重价值:从濒危保护到普惠健康

(一)濒危物种保护的“绿色方案”
合成生物学技术彻底摆脱了对野生药材的依赖,为濒危物种保护提供了创新路径:
减少生态破坏:实验室培育无需开垦土地、使用化肥农药,可避免人参种植导致的土壤退化和水源污染。
缓解资源压力:以稀有人参皂苷Rh2为例,传统方法需种植50亩人参(约10万株)方可提取1克产物,而合成生物学仅需1升酵母发酵液,资源消耗降低99.99%。
促进物种恢复:通过释放部分实验室培育的稀有皂苷用于科研,可减少对野生个体的采集需求,为濒危物种提供休养生息的时间窗口。
(二)稳定药源与普惠健康的“产业革命”
质量可控性:实验室环境可精准调控温度、pH值等参数,消除天然产物的批次差异。例如,东北林业大学团队开发的固定化酶反应器,可使Rh2的产量波动范围从传统方法的±30%缩小至±5%。
成本大幅降低:合成生物学使稀有人参皂苷的生产周期从数年缩短至数天,成本从每克2万元降至百元级。华南理工大学团队与化妆品企业合作开发的Rh1产品,已实现终端售价下降80%,惠及更多消费者。
新药开发潜力:通过组合生物合成,可创造天然不存在的稀有皂苷衍生物。例如,北京理工大学团队通过改造酵母细胞,成功合成具有更强抗肿瘤活性的新型皂苷Ro,为中药现代化注入新动能。
四、挑战与展望:从技术突破到全球领导力
(一)当前挑战:从实验室到市场的“最后一公里”
代谢通路解析不足:部分稀有皂苷的天然合成路径尚未完全明确,需结合多组学技术(如转录组、代谢组)进一步探索。
底盘细胞适配性:酵母等宿主与植物代谢网络的差异可能导致中间体积累,需通过基因回路设计优化代谢流。
规模化生产瓶颈:高密度发酵过程中溶氧、温度梯度等问题需通过生物反应器设计解决,目前全球仅少数企业具备万吨级产能。
(二)未来方向:构建全球领先的中药智造生态
技术融合创新:结合AI辅助分子设计、类器官模型等技术,实现“成分-靶点-疾病”的精准匹配,加速新药研发。
标准体系建设:推动国际标准化组织(ISO)制定合成生物学中药活性成分的质量标准,抢占全球话语权。
产业协同发展:构建“基础研究-技术转化-临床应用”全链条创新联合体,例如天津大学与云南白药合作建立的“中药合成生物学联合实验室”,已实现Rg3的吨级量产。
结语:让传统智慧绽放现代光芒
合成生物学技术正以“基因剪刀”和“细胞画笔”,重新定义中药材的制造逻辑。从实验室中的酵母细胞到生产线上的“植物黄金”,这一革命不仅为濒危物种保护提供了科技方案,更让千年中药智慧以更安全、更高效、更普惠的方式服务人类健康。未来,随着技术的持续突破,国内有望引领全球中药产业进入“智能智造”新时代,让传统瑰宝在新时代焕发勃勃生机。





















