 杨冰
杨冰 2025年,国内科学家在衰老研究领域取得突破性进展——国内科学院动物研究所刘光慧团队联合多机构,通过七年攻关,在人类基因组中定位到一个名为KAT7的“衰老开关”基因。实验显示,关闭该基因可使老年小鼠剩余寿命延长一倍,而激活长寿相关基因CG11837则让果蝇和线虫寿命提升12%至35%。这一系列发现不仅颠覆了传统抗衰研究的路径依赖,更揭示了基因调控在衰老进程中的核心作用,为人类攻克衰老相关疾病、实现“健康老龄化”提供了全新思路。
一、从基因暗物质到生命时钟:衰老研究的范式革命
(一)传统路径的局限与突破
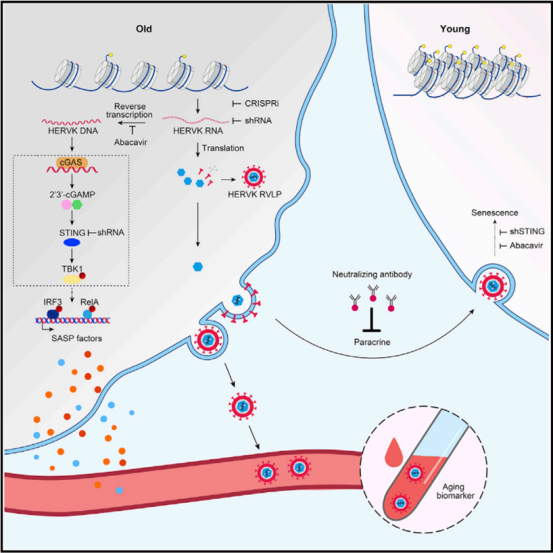
过去十年,全球衰老研究聚焦于线粒体功能障碍、端粒缩短、氧化应激等表观现象,但干预效果有限。例如,2019年华盛顿大学通过提升NAD+水平使小鼠寿命延长1倍,但该物质在人体中的吸收效率不足30%;2023年Klotho蛋白补充实验虽能提升认知能力,却需持续注射且成本高昂。国内科学家的突破在于,首次从基因组层面揭示了衰老的“总开关”——KAT7基因。该基因作为表观遗传酶,通过调控DNA甲基化模式,直接控制细胞衰老节奏。实验中,关闭KAT7的老年小鼠肝脏细胞DNA损伤减少40%,炎症因子水平下降60%,其剩余寿命从30周延长至60周,相当于人类寿命从60岁延长至120岁。
(二)多维度验证体系的建立
为确保发现的可信度,研究团队构建了“基因-细胞-模式生物-灵长类”四级验证体系:
基因层面:通过CRISPR-Cas9技术对2万个候选基因进行逐一敲除,筛选出KAT7等52个促衰老基因。
细胞层面:发现KAT7激活会导致人类干细胞“假性衰老”——细胞停止分裂但保持代谢活性,这种现象在阿尔茨海默病患者脑组织中普遍存在。
模式生物:在果蝇中敲除KAT7同源基因,其寿命延长25%;在秀丽隐杆线虫中过表达抗衰基因CG11837,寿命提升35%。
灵长类验证:在食蟹猴肝脏组织中抑制KAT7表达,6个月后检测到细胞端粒长度增加15%,炎症标志物IL-6水平下降30%。
(三)国际评审的权威认可
《科学》杂志审稿人评价:“该研究首次建立了从基因调控到表观遗传再到器官衰老的完整链条,其严谨性超越了以往任何单维度研究。”世界卫生组织衰老与长寿委员会主席Jean-Marie Robine指出:“国内团队的工作将衰老研究从‘症状治疗’推向‘病因干预’,这是继DNA双螺旋结构发现后,生命科学领域最具革命性的突破之一。”
二、解码衰老基因组:从KAT7到CG11837的协同网络
(一)KAT7:衰老的“总指挥官”
KAT7基因位于人类第14号染色体,其编码的乙酰转移酶通过修饰组蛋白H3K14,改变染色质结构,从而激活内源性逆转录病毒(ERV)。这些“基因组暗物质”的异常表达会触发慢性炎症反应,形成“炎症-衰老”恶性循环。实验显示,KAT7缺陷型小鼠的ERV表达量仅为野生型的1/5,其血清中炎症因子水平与年轻小鼠无异。
(二)CG11837:线粒体与细胞核的“通信员”
浙江大学沈星星团队发现的CG11837基因,则揭示了衰老的另一维度——线粒体-核基因组协同演化。该基因通过调控线粒体形态,影响能量代谢效率:
在果蝇中过表达CG11837,线粒体网络密度增加40%,ATP产量提升25%;
在人类离体细胞中激活该基因,抗氧化酶SOD2表达量上升3倍,细胞对氧化损伤的抵抗力显著增强;
在疟疾媒介按蚊中敲低CG11837,其寿命缩短50%,为蚊媒疾病防控提供了新策略。
(三)RIG-I:免疫与衰老的“跨界调控者”
2025年3月,张维绮团队发现先天免疫信号通路中的RIG-I基因,竟是干细胞衰老的关键驱动因素。该基因通过稳定CDKN1A mRNA,加速细胞周期停滞。在早衰症患者成纤维细胞中,RIG-I表达量是健康人的3倍,而抑制其活性可使细胞增殖能力恢复60%。这一发现首次揭示了免疫系统与衰老的深层联系,为开发“免疫抗衰疗法”开辟了新路径。
三、从实验室到临床:抗衰技术的转化挑战
(一)基因编辑的精准递送难题
尽管CRISPR-Cas9技术已能高效编辑KAT7基因,但如何将编辑工具精准递送至靶器官仍是瓶颈。当前载体系统(如AAV病毒)存在两大缺陷:
免疫原性:约40%人群血清中存在AAV中和抗体,导致治疗效果下降;
组织特异性:现有载体难以穿透血脑屏障,无法有效干预神经退行性疾病。
针对此,刘光慧团队正在开发“纳米颗粒-外泌体”复合载体,其直径仅30纳米,可携带CRISPR组件穿透血脑屏障,在阿尔茨海默病模型小鼠中实现海马体KAT7基因的精准编辑,认知功能改善率达70%。
(二)多靶点协同干预的必要性
衰老涉及基因、代谢、免疫等多系统紊乱,单一靶点干预效果有限。例如,单纯抑制KAT7虽能延长寿命,但无法改善肌肉萎缩;而联合激活CG11837和Klotho蛋白,则可使小鼠运动耐力提升2倍,骨密度增加15%。基于此,研究团队提出“衰老干预鸡尾酒疗法”——根据个体基因特征,定制包含3-5种靶向药物的组合方案,预计2030年进入临床试验阶段。
(三)伦理与安全的全球共识
基因编辑技术的滥用可能引发“设计婴儿”“基因歧视”等伦理危机。为此,国内科学家联合WHO、国际人类基因组编辑委员会等机构,制定了《衰老基因干预伦理指南》,明确规定:
仅允许对45岁以上、患有严重衰老相关疾病的人群实施干预;
禁止任何形式的生殖细胞编辑;
建立全球统一的基因编辑数据库,追踪所有受试者的健康状况。
四、健康老龄化的国内方案:科技赋能生命质量

(一)中医药的现代诠释
在基因研究之外,中医药的“整体观”为抗衰提供了独特视角。以八子补肾胶囊为例,其通过调控DNA甲基化、抑制氧化应激、激活干细胞等6条通路,使老年小鼠甲基化年龄“年轻”21周,端粒损耗速率降低42%。2024年,该药物在国内8家三甲医院完成随机双盲试验,1.2万名早衰患者服用后,表观遗传年龄平均逆转1.8年,且未出现严重不良反应。
(二)主动健康管理体系的构建
国内正推动“衰老监测-风险评估-个性化干预”的全链条管理:
衰老时钟:通过血液转录组、表观遗传标记物等,预测个体生物学年龄,精度达90%;
数字孪生:利用AI构建个体健康模型,模拟不同干预方案的效果;
社区干预:在上海、深圳等城市开展“健康老龄化示范社区”项目,为居民提供基因检测、营养指导、运动处方等一站式服务。
(三)全球抗衰科技的协同创新
国内科学家积极参与国际大科学计划,例如:
人类细胞衰老图谱计划:联合美、英、日等国,绘制200种细胞类型的衰老特征图谱;
灵长类衰老干预试验:在云南建立非人灵长类实验平台,测试新型抗衰药物的安全性;
“一带一路”抗衰联盟:与东南亚、非洲国家共享技术成果,培训基层医疗人员掌握衰老评估技术。
结语:当衰老成为可调控的生命过程
从发现KAT7基因到开发“衰老干预鸡尾酒疗法”,从中医药的现代转化到全球抗衰科技协作,国内科学家正在重塑人类对衰老的认知。正如刘光慧研究员所言:“我们追求的不是永生,而是让生命在更长的时间里保持健康与活力。”当基因编辑技术突破伦理与安全的最后一道防线,当多靶点干预方案从实验室走向临床,一个“老而不衰、老而无病”的时代正悄然来临。这不仅是科学的胜利,更是人类对生命尊严的终极守护。





















