 杨冰
杨冰 2025年,癌症治疗领域迎来了一项里程碑式的突破——美国Moderna公司与默沙东公司联合开发的mRNA个性化癌症疫苗,在黑色素瘤治疗中取得了显著成效。临床试验数据显示,该疫苗与PD-1抑制剂Keytruda联用,可将高危黑色素瘤患者的复发或死亡风险降低44%。这一成果不仅为黑色素瘤患者带来了新的希望,也标志着癌症治疗从“广谱杀伤”向“精准免疫”模式的转变。本文将从技术原理、临床数据、市场前景与患者影响四个维度,深度剖析mRNA个性化癌症疫苗的突破性进展。
一、技术原理:mRNA疫苗的精准免疫机制
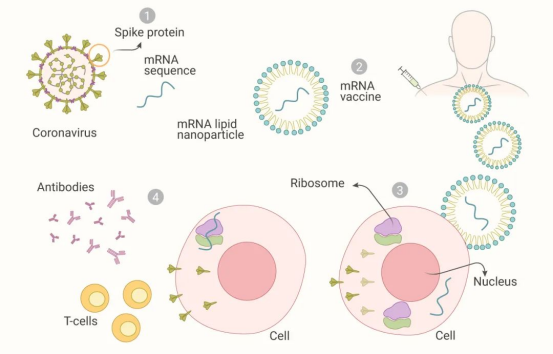
1. 个性化定制:基于患者肿瘤突变的“私人订制”
mRNA个性化癌症疫苗的核心在于其“量身定制”的特性。与传统疫苗不同,mRNA疫苗并非针对某种固定抗原,而是通过分析患者肿瘤的DNA突变特征,设计出针对特定突变的mRNA序列。具体流程如下:
肿瘤样本采集:患者在接受肿瘤切除手术后,医生会取下部分肿瘤组织;
基因测序:利用高通量测序技术,对肿瘤组织进行全基因组测序,识别出患者特有的肿瘤突变位点;
疫苗设计:基于测序结果,设计出编码多达34种新抗原的单一合成mRNA分子;
疫苗生产:通过体外转录技术,将设计好的mRNA序列合成疫苗,整个过程仅需约8周。
2. 免疫激活:解除肿瘤微环境的免疫抑制
mRNA疫苗进入人体后,会激活免疫系统,产生特异性T细胞抗肿瘤反应。其作用机制包括:
抗原呈递:mRNA疫苗被注射入体内后,会被抗原呈递细胞(如树突状细胞)摄取,翻译成蛋白质抗原;
T细胞激活:抗原呈递细胞将抗原呈递给T细胞,激活CD8+细胞毒性T细胞和CD4+辅助T细胞;
免疫记忆形成:激活的T细胞会分化为记忆T细胞,长期驻留在体内,形成免疫记忆,防止肿瘤复发。
3. 安全性优势:避免基因整合与长期副作用
相比DNA疫苗,mRNA疫苗具有显著的安全性优势:
不进入细胞核:mRNA疫苗仅在细胞质中发挥作用,不会整合到宿主基因组中,避免了潜在的基因突变风险;
快速降解:mRNA在体内可被快速降解,半衰期仅为数小时至数天,减少了长期副作用的可能性;
低毒性:临床试验数据显示,mRNA疫苗与Keytruda联用的安全性良好,≥3级不良事件发生率仅为25%,与Keytruda单药治疗组(20%)相当。
二、临床数据:黑色素瘤治疗的革命性突破
1. 关键临床试验:KEYNOTE-942研究的里程碑意义
KEYNOTE-942是一项随机、开放标签的2b期临床试验,共招募了157名III/IV期黑色素瘤患者。患者在进行肿瘤完全手术切除后,按照2:1的比例被随机分配为两组:
联合治疗组:接受mRNA-4157(每三周1次,共9次剂量)与Keytruda(每三周200毫克,最多18个疗程)联合治疗;
单药治疗组:仅接受Keytruda单药治疗。
研究结果显示:
无复发生存期(RFS):联合治疗组的2.5年无复发生存率为74.8%,而单药治疗组仅为55.6%;
复发或死亡风险:联合治疗组将患者的复发或死亡风险降低了49%;
远处转移或死亡风险:联合治疗组将患者的远处转移或死亡风险降低了62%。
2. 长期随访数据:疗效的持续性与稳定性
在KEYNOTE-942研究的长期随访中,mRNA-4157与Keytruda联用的疗效得到了进一步验证:
3年无复发生存率:联合治疗组的3年无复发生存率为70%,而单药治疗组为50%;
亚组分析:在高肿瘤突变负荷(TMB)、非高TMB、PD-L1阳性、PD-L1阴性和ctDNA阴性亚组中,联合治疗组的RFS获益均得以维持;
总生存期(OS):联合治疗组的2.5年总生存率为96.0%,而单药治疗组为90.2%。
3. 安全性数据:耐受性良好,副作用可控
在KEYNOTE-942研究中,mRNA-4157与Keytruda联用的安全性良好:
不良事件:联合治疗组报告的≥3级不良事件的患者比例约为25%,Keytruda单药治疗组约为20%;
最常见不良事件:联合治疗组最常见的任何级别的不良事件是疲劳(60.6%)、注射部位疼痛(56.7%)和寒战(49%);
免疫相关不良事件:联合治疗组未增强免疫相关不良事件,安全性与先前分析一致。
三、市场前景:癌症疫苗的商业化之路
1. 市场规模:黑色素瘤治疗的巨大潜力
黑色素瘤是一种由皮肤中的黑色素细胞恶变形成的恶性肿瘤,属于皮肤癌中最危险的类型。据统计:
发病率:全球每年新发黑色素瘤病例约32万例,占皮肤癌症总数的5%;
死亡率:黑色素瘤的死亡病例数占皮肤癌症死亡总数的75%;
五年生存率:早期黑色素瘤患者的五年生存率超过90%,但中晚期患者的五年生存率仅为16.2%-60.3%。
mRNA个性化癌症疫苗的推出,有望显著改善黑色素瘤患者的预后,市场规模巨大。据预测,2027年全球黑色素瘤治疗市场规模将达到50亿美元,其中mRNA疫苗将占据重要份额。
2. 竞争格局:Moderna与BioNTech的双雄争霸
在mRNA癌症疫苗领域,Moderna与BioNTech是两大领军企业:
Moderna:其mRNA-4157疫苗已进入Ⅲ期临床试验,预期最早在2027年上市。除黑色素瘤外,该疫苗还在非小细胞肺癌、鳞癌等领域开展临床试验;
BioNTech:其BNT111疫苗已进入Ⅱ期临床试验,与PD-1抑制剂Cemiplimab联用,针对晚期黑色素瘤患者。BNT111疫苗编码四种与黑色素瘤密切相关的非突变抗原,制备过程相对简单,通过静脉注射给药。
3. 商业化挑战:价格、可及性与支付体系
尽管mRNA个性化癌症疫苗前景广阔,但其商业化仍面临诸多挑战:
价格高昂:mRNA疫苗的生产成本较高,预计单针价格将超过10万美元;
可及性:mRNA疫苗的生产周期较长,且需要高度个性化的定制,难以大规模生产;
支付体系:目前,mRNA疫苗尚未纳入医保报销范围,患者需自费支付高额费用。
四、患者影响:从绝望到希望的转变

1. 生存希望:复发风险的显著降低
对于高危黑色素瘤患者而言,mRNA个性化癌症疫苗的推出意味着生存希望的显著提升。以李先生为例,他在2024年被诊断为III期黑色素瘤,接受了肿瘤切除手术后,参与了mRNA-4157与Keytruda联合治疗的临床试验。经过两年的随访,李先生的肿瘤未出现复发迹象,生活质量得到了显著改善。
2. 生活质量:传统疗法的“广谱毒性”减免
传统癌症治疗方法(如化疗、放疗)往往伴随着严重的副作用,影响患者的生活质量。而mRNA个性化癌症疫苗作为辅助治疗,可在一定程度上减免传统疗法的“广谱毒性”:
减少化疗次数:部分患者在接受mRNA疫苗治疗后,可减少化疗的次数和剂量;
降低副作用:mRNA疫苗的副作用相对较轻,主要为疲劳、注射部位疼痛等,患者耐受性良好。
3. 心理支持:从恐惧到安心的转变
癌症的诊断往往给患者带来巨大的心理压力,而mRNA个性化癌症疫苗的推出,为患者提供了心理支持:
增强信心:患者了解到mRNA疫苗的显著疗效后,对治疗的信心显著增强;
减少焦虑:mRNA疫苗的长期免疫记忆形成,有望预防肿瘤复发,减少了患者的焦虑情绪。
五、未来展望:癌症治疗的精准免疫时代
1. 技术迭代:从黑色素瘤到更多癌症类型
mRNA个性化癌症疫苗的成功,标志着癌症治疗从“广谱杀伤”向“精准免疫”模式的转变。未来,mRNA疫苗有望扩展到更多癌症类型:
非小细胞肺癌:Moderna已启动mRNA-4157与Keytruda联用治疗非小细胞肺癌的Ⅲ期临床试验;
鳞癌:mRNA-4157也在鳞癌领域开展临床试验;
其他实体瘤:mRNA疫苗在胃癌、肝癌、脑胶质瘤等领域也展现出了良好的应用前景。
2. 联合疗法:mRNA疫苗与免疫检查点抑制剂的协同作用
mRNA疫苗与免疫检查点抑制剂的联合疗法,已成为癌症治疗的新趋势。未来,更多联合疗法将涌现:
双免疫检查点抑制剂:mRNA疫苗与PD-1抑制剂、CTLA-4抑制剂的联合使用,有望进一步提高疗效;
靶向药物:mRNA疫苗与靶向药物的联合使用,可针对肿瘤的特定靶点,实现精准治疗;
细胞疗法:mRNA疫苗与CAR-T疗法、TCR-T疗法的联合使用,有望增强细胞疗法的疗效。
3. 政策支持:医保覆盖与支付体系创新
为推动mRNA个性化癌症疫苗的普及,政策支持至关重要:
医保覆盖:将mRNA疫苗纳入医保报销范围,减轻患者的经济负担;
支付体系创新:探索“按疗效付费”“分期付款”等创新支付模式,提高患者的可及性;
研发支持:政府加大对mRNA疫苗研发的支持力度,推动技术迭代与成本下降。
结语:癌症治疗的未来已来
mRNA个性化癌症疫苗的推出,标志着癌症治疗进入了一个全新的时代。从黑色素瘤到更多癌症类型,从“广谱杀伤”到“精准免疫”,mRNA疫苗正以其独特的优势,改变着癌症治疗的格局。尽管面临价格高昂、可及性有限等挑战,但随着技术迭代、政策支持与市场推广,mRNA疫苗有望成为癌症治疗的主流手段,为更多患者带来生的希望。未来,癌症治疗的精准免疫时代已经到来,让我们共同期待这一领域的更多突破与进展。





















