 杨冰
杨冰 动脉粥样硬化性心血管疾病作为全球致死率最高的慢性病,其核心致病因子——低密度脂蛋白胆固醇(LDL-C)的长期控制一直是医学界难题。传统他汀类药物需每日服用,PCSK9抑制剂仍需每月注射,患者依从性不足导致疾病复发率居高不下。2025年,基于表观遗传编辑技术的基因疗法取得突破性进展,通过单次注射实现LDL-C水平持久性降低,标志着心血管疾病治疗进入"一针管终生"的新纪元。
一、技术突破:从基因编辑到表观遗传调控
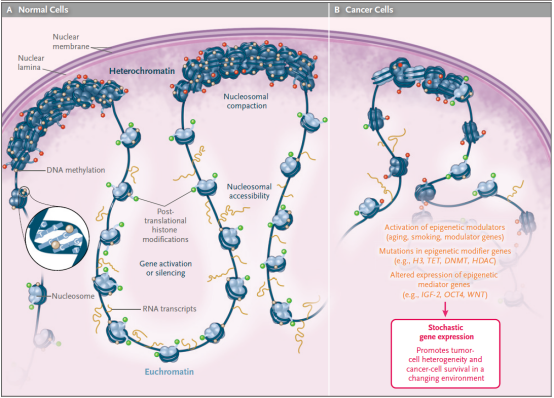
1. PCSK9基因靶向的病理学基础
PCSK9蛋白通过与低密度脂蛋白受体(LDLR)结合,加速其溶酶体降解,导致血液中LDL-C水平升高。家族性高胆固醇血症患者携带PCSK9功能获得性突变时,LDL-C水平可升高3-5倍,冠心病风险增加13倍。传统治疗手段如他汀类药物虽能抑制胆固醇合成,但PCSK9蛋白的代偿性上调会削弱疗效,而PCSK9抑制剂需频繁注射且存在抗体产生风险。
2. 表观遗传编辑的技术革新
与CRISPR基因编辑技术不同,表观遗传编辑通过DNA甲基化实现基因沉默,不改变DNA序列,避免脱靶切割引发的基因毒性。2025年《自然·医学》发表的研究显示,科学家开发的表观遗传编辑器(EE)由DNA甲基转移酶(DNMT3A/DNMT3L)、转录抑制结构域(KRAB)和失活Cas9(dCas9)组成,通过脂质纳米颗粒(LNP)递送至肝脏后,可特异性靶向PCSK9基因启动子区域,诱导CpG岛甲基化,使基因表达沉默。
3. 动物实验的突破性数据
在转基因小鼠模型中,单次注射EE后,血浆PCSK9水平在28天内降低98%,效果持续1年以上。即使经历部分肝切除诱导的肝脏再生,甲基化标记仍稳定存在,证明基因沉默效果可遗传至新生肝细胞。在非人灵长类动物实验中,1.0 mg/kg剂量的EE使PCSK9蛋白水平下降89%,LDL-C降低68%,肝脏活检显示靶向区域DNA甲基化水平显著升高,且与血脂降低呈强相关。
二、临床应用:从实验室到人体的跨越
1. 首次人体试验的里程碑进展
2025年2月,Verve Therapeutics公司启动的VERVE-102临床试验,首次在家族性高胆固醇血症患者中验证表观遗传编辑疗法的安全性与有效性。10名患者接受单次静脉注射后,功能性PCSK9蛋白水平平均下降62%,LDL-C水平降低47%,效果持续6个月。值得关注的是,该疗法未引发显著免疫反应,且肝脏转氨酶水平无异常升高,证明其安全性优于传统基因编辑技术。
2. 长期疗效的分子机制
研究显示,EE诱导的DNA甲基化标记在肝细胞分裂过程中可忠实传递,即使肝脏经历完全再生,甲基化水平仍维持稳定。这种"表观遗传记忆"效应源于DNA甲基转移酶1(DNMT1)在DNA复制时对新合成链的甲基化修复。此外,研究人员开发的去甲基化激活工具(dCas-Tet)可逆转PCSK9的沉默状态,证明表观遗传编辑具有可逆性,为未来治疗方案的动态调整提供可能。
3. 特殊人群的治疗潜力
对于杂合子家族性高胆固醇血症(HeFH)患者,该疗法展现显著优势。这类患者携带一个正常PCSK9等位基因和一个功能获得性突变等位基因,传统疗法难以完全抑制PCSK9活性。而EE通过双等位基因甲基化沉默,可使LDL-C水平降低至健康人群水平。此外,对于不耐受他汀类药物的患者,表观遗传编辑疗法提供无需每日服药的替代方案。
三、技术优势:精准、长效与安全的三重突破
1. 持久降脂的疗效优势
与传统PCSK9抑制剂相比,表观遗传编辑疗法实现单次注射后LDL-C水平持续降低。临床前研究显示,非人灵长类动物接受治疗后,LDL-C降低幅度达70%,显著高于抗体药物(50%-60%)和RNAi疗法(60%)。这种深度降脂效应源于PCSK9基因的完全沉默,而非传统疗法的蛋白功能抑制,从根本上阻断胆固醇代谢的病理通路。
2. 脱靶效应的精准控制
全基因组甲基化测序显示,EE仅在PCSK9启动子区诱导显著甲基化,未引发其他基因表达异常。这种特异性源于dCas9蛋白与向导RNA(gRNA)的精准配对,其靶向窗口限制在启动子区域约1.5 kb范围内。相比之下,CRISPR-Cas9基因编辑可能引发染色体大片段缺失或重排,而碱基编辑技术虽减少脱靶,但仍存在单碱基突变风险。
3. 安全性与可逆性的临床价值
表观遗传编辑不破坏DNA双链结构,避免非同源末端连接(NHEJ)修复引发的插入缺失突变。在非人灵长类动物长期观察中,未发现肝脏肿瘤、免疫原性反应或器官毒性。此外,dCas-Tet工具的开发使治疗具有"安全开关"功能,可在必要时恢复PCSK9表达,为药物安全性提供双重保障。
四、挑战与展望:从技术突破到临床普及

1. 递送系统的效率瓶颈
当前LNP递送效率仍存在个体差异,部分患者肝脏靶向性不足。为解决这一问题,研究人员正在开发第三代LNP配方,通过修饰脂质成分提高肝细胞摄取率。此外,腺相关病毒(AAV)载体递送系统也在探索中,其优势在于可实现长期基因表达,但需克服预存免疫和载体容量限制。
2. 成本与可及性的现实问题
基因疗法的高昂成本(如Zolgensma定价210万美元)引发支付体系担忧。为降低治疗费用,Verve Therapeutics公司采用mRNA-LNP技术路线,避免病毒载体生产的复杂性。此外,规模化生产工艺的优化有望使单次治疗成本降至10万美元以下,接近肝脏移植费用水平。
3. 监管审批的严格标准
FDA要求基因疗法提供至少5年的长期安全性数据,尤其是对生殖细胞的潜在影响。尽管EE不改变生殖系DNA,但监管机构仍要求开展跨代遗传学研究。此外,表观遗传编辑的可逆性特征需建立动态监测指标,如甲基化水平、PCSK9表达量与LDL-C的剂量效应关系。
4. 未来治疗的扩展前景
表观遗传编辑技术的平台化特性使其可拓展至其他代谢性疾病。例如,通过靶向ANGPTL3基因降低甘油三酯,或抑制APOC3基因改善高密度脂蛋白功能。此外,该技术与纳米机器人清斑技术的联合应用,可能实现动脉粥样硬化的"标本兼治"——基因疗法调控血脂,纳米机器人清除已有斑块。
结语
表观遗传编辑技术的突破,使心血管疾病治疗从"症状控制"迈向"疾病根治"。单次注射实现LDL-C水平持久降低,不仅解放患者免受终身服药之苦,更通过基因层面的调控阻断疾病进展。尽管临床转化仍面临递送效率、成本与监管等挑战,但随着CRISPR 2.0技术、类器官模型与AI药物设计的融合,基因疗法有望在10年内成为心血管疾病的一线治疗方案。这场静默的基因革命,正在改写人类对抗代谢性疾病的历史。





















